Teoria e Aplicações
POTENCIOMETRIA E ELETRODOS PARA pH
A medição potenciométrica do pH requer um eletrodo indicador e um eletrodo de referência, cada eletrodo constituindo uma meia-célula. A meia-célula que corresponde ao eletrodo de referência gera uma voltagem constante e que não depende do pH.
A meia-célula correspondendo ao eletrodo indicador é constituida por um eletrodo de vidro. A membrana deste eletrodo, que tem geralmente a forma de um bulbo, é fabricada a partir de um vidro especial de composição rigorosamente controlada. Esse vidro apresenta uma propriedade singular que o distingue dos vidros comuns: o contato com uma solução aquosa provoca uma modificação superficial da estrutura.
Tudo se passa como se a água da solução transformasse a camada externa do vidro, inicialmente dura e compactada, numa película hidratada do tipo gel. Essa camada gelatinosa extremamente fina permite a penetração dos íons H+ e, consequentemente, o aparecimento de uma voltagem que é função linear do pH.
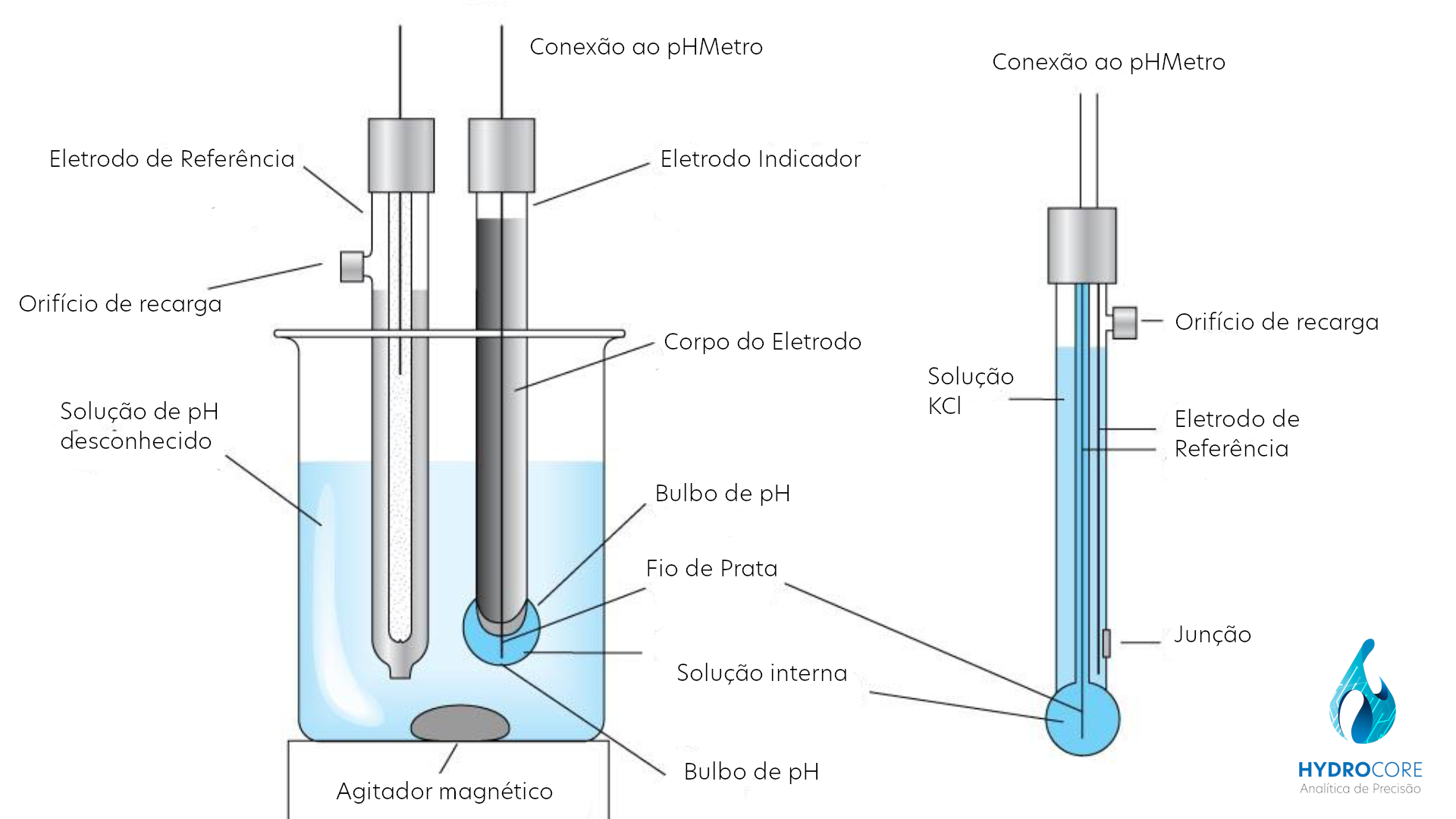
ELETRODO COMBINADO DE pH
Por razões de comodidade, simplicidade e economia, as duas meia-células descritas podem ser reunidas num eletrodo só. O eletrodo combinado pode ser visualizado como uma bateria completa cuja voltagem mudaria de acordo com o pH da solução na qual ele está mergulhado.
ELETRODO E A TEMPERATURA
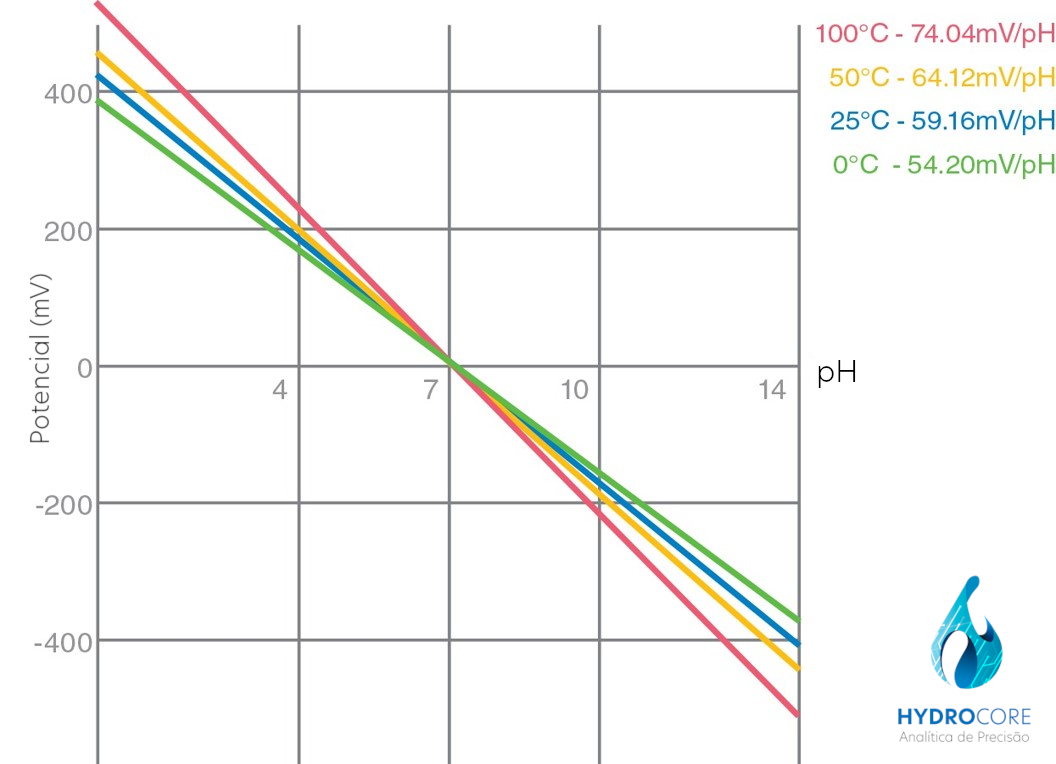
À uma temperatura de 25 ºC, o eletrodo de pH gera um potencial de 59 mV para cada unidade de pH. A uma temperatura de 50 ºC, o potencial gerado é de 65 mV e a 100º C, 74 mV.
Vê-se que a representação gráfica dessa voltagem, em função do valor do pH, é uma reta cuja inclinação depende da temperatura. A cada valor da temperatura corresponde uma reta diferente.
Todas as retas se cruzam num só ponto, chamado intersecção das isotermas. Para os eletrodos HYDROCORE, esse ponto tem como coordenadas aproximativas 0 mV e pH = 7.
O potenciômetro da compensação térmica, equipando os medidores de pH, (medidores de laboratório tanto os medidores industriais), deve ser adaptado a esse ponto de forma que uma calibração do eletrodo, realizada a uma dada temperatura, permita a medição do pH da solução amostra a uma outra temperatura.
POTENCIAL DE ASSIMETRIA
Supomos que dentro do bulbo do eletrodo de pH esteja colocado uma solução de pH = 7, e que o mesmo se encontrasse mergulhado numa solução também de pH = 7.
Neste caso, para um eletrodo ideal, o potencial medido entre os dois lados do bulbo deveria ser nula. No entanto, para o eletodo real, o potencial toma valores pequenos não nulos, que variam com o decorrer do tempo.
Chama-se de Potencial de Assimetria esse potencial residual variável e desconhecido. Decorre disso que o potencial medido entre o terminal do eletrodo de pH e o terminal do eletrodo de referência nunca é definida em valor absoluto.
NECESSIDADE DE CALIBRAÇÃO
O potencial gerado pelo eletrodo de pH é convertido, pelo medidor, numa leitura do pH.
Todavia, a presença de um potencial de assimetria superposto ao produzido pelo eletrodo, não permitiria uma conversão precisa. A calibração do conjunto eletrodo/medidor consiste em cancelar o potencial de assimetria por meio de um potencial quantitativamente igual mas de sinal oposto.
Durante a calibração o eletrodo é mergulhado numa solução tampão de pH de valor conhecido.
Visto que o potencial de assimetria não permanece constante, essa calibração deve ser realizada antes de cada medição.
RESPOSTA DO ELETRODO E AJUSTE DO GANHO
No caso ideal, por unidade de pH, o eletrodo de pH desenvolve um pontecial de 59,16 mV a 25º C.
Esse valor é chamado de resposta do eletrodo. Na prática, observam-se pequenos desvios do comportamento ideal. Para eliminá-los utilizam-se duas soluções tampão de pH conhecido. A primeira, como visto anteriormente, é usada para a calibração, quer dizer, o cancelamento do potencial de assimetria. A segunda solução permite ajustar eletrônicamente o ganho do medidor de pH para a inclinação correta da reta de resposta do eletrodo.
CASO TÍPICO
A) Para faixa ácida:
-
Mergulhar o eletrodo num tampão de pH = 7,00 (ou próximo a esse valor). O uso do pHMetro permitirá cancelar o potencial de assimetria do eletrodo.
-
Em seguida, com o eletrodo mergulhado no tampão de pH = 4,00 o uso do pHMetro permitirá corrigir a inclinação da reta mV/pH para o valor correto.
B) Para faixa básica:
- Usar um tampão de pH = 7,00
- Em seguida, usar o tampão de pH = 10,00
CAUSAS PERTUBADORAS AFETANDO O ELETRODO DE MEDIÇÃO
O potencial gerado pelo eletrodo, que varia linearmente com o pH, tem sua fonte na camada hidratada que se forma durante a fase inicial de condicionamento. Portanto, os agentes químicos capazes de pertubar, alterar ou dissolver essa camada, e posteriormente, o vidro subjacente, são também os responsáveis do mal funcionamento do eletrodo.
Além do mais, fatores puramente físicos podem também pertubar o eletrodo.
1) SOLUÇÕES DE ÁCIDO FLUORÍDRICO
Atacam rapidamente a camada hidratada do bulbo do eletrodo o que provoca instabilidade nos valores aparentes do pH além de uma deriva do valor indicado pelo medidor de pH. Se persistir o contato, a dissolução do vidro prossegue com uma velocidade constante dependendo da concentração da concentração do ácido e da temperatura.
Se o eletrodo for retirado da solução e mergulhado em água ligeiramente acidulada ou melhor, numa solução tampão ácida, há reformação de uma nova camada hidratada e o eletrodo volta a funcionar normalmente.
2) SOLUÇÕES DE FLUORETOS
Abaixo de pH = 4 os efeitos são similares aos já descritos para o ácido fluorídrico.
3) SOLUÇÕES FORTEMENTE ALCALINAS OU SOLUÇÕES SALGADAS COM pH ELEVADO
Atacam o vidro através de um processo de dissolução da estrutura silicitada. A partir de pH = 13 e a 100ºC a velocidade do ataque é considerávelmente danosa e acelerada.
4) PROTEÍNAS, POLIELETRÓLITOS E AGENTES TENSIOATIVOS
Apresentam uma tendência marcada a serem absorvidos sobre a membrana de vidro. A barreira formada pelas moléculas adsorvidas, aos poucos impede a livre difusão dos íons H+ até o bulbo, o que acarreta uma diminuição progressiva da porcentagem de resposta do eletrodo e uma lentidão no estabelecimento do potencial.
5) SOLUÇÕES OLEOSAS OU GORDUROSAS
Podem bloquear a membrana através de um processo de adsorção sobre a camada hidratada com uma consequente diminuição ou, até, perda de resposta do eletrodo.
6) BAIXA TEMPERATURA (< - 5 ºC)
A resistência elétrica da membrana de vidro aumenta consideravelmente a baixa temperatura o que pode ocasionar erros devido ao efeito de divisão da tensão.
MANUTENÇÃO DOS ELETRODOS DE VIDRO
Periódicamente inspecione o bulbo do eletrodo de vidro e procure a presença de filmes ou depósitos de substâncias contaminantes. Quanto mais cedo são detectados, quanto mais facilmente são removidos. Limpe o bulbo com um pano umedecido e detergente comercial. Não esfregue o bulbo com força excessiva para evitar o aparecimento de cargas elétricas estáticas. Em seguida, segure o eletrodo de modo que o bulbo permaneça alguns instantes debaixo do jato de água da torneira.
RECUPERAÇÃO DOS ELETRODOS DE VIDRO
Após uso prolongado, em soluções contendo proteínas, polietrólitos ou substâncias oleosas ou gordurosas, filmes ou depósitos aderentes podem se formar sobre o bulbo do eletrodo apesar da manutenção periódica. Tais depósitos devem ser removidos porque diminuem a porcentagem de resposta do eletrodo, o que dificulta e até impossibilita a calibração com tampões e aumentam o seu tempo de estabilização. Para completa remoção dos filmes e depósitos, aplique um tratamento gradativo:
- Mergulhe o bulbo do eletrodo alternadamente numa solução de HCl 0,1 M e de NaOH 0,1 M.
5 minutos em cada solução, repetidas vezes. - Caso o tratamento anterior fique sem efeito, mergulhe o bulbo numa solução de HCl a 20% (solução ± 6 M) durante 10 minutos e, passado esse tempo, enxague abundantemente debaixo do jato de água de uma torneira.
- Em última instância, mergulhe o bulbo 1 ou 2 minutos na solução sulfocrômica (32g de dicromato de potássio dissolvido para 1 litro de ácido sulfúrico técnico). Em seguida, enxague abundantemente com água. Depois desse tratamento, é imprescindível recondicionar o eletrodo algumas horas na Solução de Descanso de Eletrodo HC0018)
Quando os tratamentos anteriores permanecerem sem efeito sobre o desempenho do eletrodo ou quando o mesmo passou por condições operacionais severas (exposição prolongada a alta temperatura ou a alta concentração em sais de sódio, ciclisação da temperatura durante longos períodos, contato prolongado com substâncias desidratantes, etc.) uma rejuvenescência da membrana é indicada.
PROCEDIMENTO DE REJUVENESCÊNCIA DE ELETRODO
Mergulhe o bulbo do eletrodo na Solução Regeneradora de Eletrodo HC0017 durante 20 segundos. Enxague imediatamente com bastante água e recondicione o eletrodo algumas horas na Solução de Descanso de Eletrodo HC0018.
NOTA
O tratamento descrito é, obviamente, sem efeito sobre um eletrodo que estaria com a membrana trincada ou em circuito aberto (condutor central quebrado) ou em curto-circuito (condução entre o condutor central e a malha metálica externa).
CONSERVAÇÃO DOS ELETRODOS DE VIDRO
O eletrodo de medição que, temporariamente não está em uso, deve ser adequadamente conservado. A aplicação de algumas regras simples manterá o eletrodo sempre pronto para uso e aumentará o seu tempo de vida.
- Limpe o eletrodo de vidro de acordo com o esquema indicado no item "Manutenção dos eletrodos de vidro" e nas recomendações do Manual de Instruções do seu eletrodo.
- Para conservação dos eletrodos utilize a Solução de Descanso de Eletrodo HC0018.
- O eletrodo combinado deve ser guardado numa solução que conserva ao mesmo tempo a membrana de vidro e a junção cerâmica do compartimento de referência. Use a Solução de Descanso de Eletrodo HC0018. É preciso lembrar que durante o período de conservação do eletrodo (como também durante o uso) o nível do eletrólito no compartimento de referência deve ser mantido alguns centímetros acima do nível da solução de conservação (para que a pressão hidrostática seja maior dentro do eletrodo do que na solução, o que garante o escoamento do eletrólito pela junção)
ELETRODOS DE REFERÊNCIA
A função dos eletrodos de referência é fornecer um potencial de referência estável e completar o circuito elétrico durante as medições com eletrodos de pH, eletrodos íons-sensíveis ou eletrodos redox. Os tipos mais conhecidos e mais usados são: o eletrodo de Calomelano Hg/Hg2Cl2 , o eletrodo de Ag/AgCl (Prata/Cloreto de Prata), Óxido de Mercúrio (II) Hg/HgO, Sulfato de Mercúrio (I) / Mercuroso Hg/Hg2SO4 e Sulfato de Cobre Cu/CuSO4 .
ELETRODO AO CALOMELANO
Esse eletrodo utiliza o sistema Mercúrio/Cloreto de Mercúrio (I) / Solução de KCl (Saturado): Hg/Hg2Cl2/KCl Sat.
É um eletrodo muito estável, recomendado para medição do pH em laboratórios clínicos, em soluções contendo proteínas e similares e em soluções contendo metais pesados que reagem com o sistema Ag/AgCl. Todavia, a decomposição térmica do Calomelano inicia-se a 70 ºC e, por essa razão, limita o uso do eletrodo até a essa temperatura.
As substâncias que podem envenenar o eletrodo são os sulfetos, os complexantes dos íons Hg+, os oxidantes e redutores fortes.
O eletrodo deve ser protegido da penetração dessas substâncias usando um eletrólito intermediário (ponte salina ou eletrodo de corpo duplo).
ELETRODO DE PRATA/CLORETO DE PRATA
Esse eletrodo utiliza o sistema Prata/Cloreto de Prata / KCl
A estabilidade térmica desse eletrodo junto com a sua simplicidade de construção contribuiam a universalizar o seu uso em potenciometria. Para determinação do pH em processos industriais, o eletrodo de referência quase que exclusivamente usado é este.
Quando o eletrólito usado é a solução de cloreto de potássio saturado, o eletrodo é utilizável até 105ºC e sem surpressão.
Visto que a solubilidade do cloreto de prata aumenta fortemente com a temperatura (formação de complexos com íons Cl-) um excesso de cloreto de prata sólido deve estar sempre presente no sistema.
As substâncias nocivas para o eletrodo são os brometos, iodetos, cianetos, sulfetos, os complexantes dos íons Ag+, os oxidantes e redutores fortes. O eletrodo deve ser protegido da penetração dessas substâncias usando um eletrólito intermediário (ponte salina ou eletrodo de corpo duplo)
VALORES DOS POTENCIAIS DE ELETRODO
Em relação ao eletrodo normal de hidrogênio os potenciais gerados pelos eletrodos de referência são: Hg/Hg2Cl2/KCl Sat.: 244 mV (a 25 ºC) - Ag/AgCl/KCl Sat.: 197 mV (a 25 ºC).
ELEMENTO ESSENCIAL DO ELETRODO DE REFERÊNCIA: SUA JUNÇÃO
Quando associado a um eletrodo indicador (de pH, Redox ou íon-sensível) o eletordo de referência, entre outras funções, deve completar o circuito elétrico formado pelas duas meia-células e a solução. Para tanto, deve existir, entre o compartimento interno do eletrodo e a solução externa, algum caminho de continuidade. Essa necessária porta de saída para o escoamento lento, ou para difusão dos íons do eletrólito de referência, é chamada de junção.
Fisicamente construída com materiais porosos ou com dispositivos que restringem o livre escoamento do eletrólito, a junção é o lugar estratégico do eletrodo.
JUNÇÃO: POTENCIAL DE DIFUSÃO
Seja qual for a sua configuração, a junção constitui uma interface onde soluções de composição e concentração diferentes se encontram.
O potencial de difusão aparecendo nesse lugar tem como origem a velocidade de transferência diferente dos diversos íons. No entanto, esse potencial que irá se somar ao potencial do eletrodo indicador constitui um elemento perturbador pois determina uma incerteza de medição. Por essa razão, o seu valor deve ser mantido a um mínimo.
NA PRÁTICA:
- O potencial de difusão é o menor quando a mobilidade dos ânions e dos cátions do eletrólito de referência é a mais próxima possível. Com a mobilidade dos íons K+ sendo muito próxima da mobilidade dos íons CI-, o uso do cloreto de potássio (KCl) satisfaz essa condição. Pela mesma razão, o nitrato de potássio (KNO3) é recomendado para as pontes salinas ou para os eletrodos de referência de corpo duplo. Todavia, mesmo para esses tipos de eletrólitos ideais, o potencial de difusão toma valores elevados para os valores extremos do pH (nas interfaces KCl/Ácido forte ou KCl/Base forte).
- O valor do potencial de difusão é elevado quando a mobilidade dos ânions e dos cátions da solução é muito diferente. É o caso das soluções muito ácidas ou muito alcalinas, pois as mobilidades dos íons H+ e OH- são muito maiores daquela do ânion ácido e do cátion básico.
Valores elevados do potencial de difusão são geralmente encontrados:
- Quando as concentrações do eletrólito de referência e da solução amostra são muito diferentes (exemplo: a determinação do pH na água pura). Nas suspensões, emulsões e soluções coloidais onde a fase dispersa, que leva geralmente uma carga negativa, reduz considerávelmente a mobilidade do íon Cl- .
Efeito de dispersão que pode acarretar erros de até 2 unidades de pH.
- Quando os materiais porosos constituindo a junção são contaminados e parcialmente entupidos.
MANUTENÇÃO E RECUPERAÇÃO
A causa mais frequente do mal funcionamento do eletrodo de referência é o entupimento parcial ou total de sua junção. Aproximadamente 70% das dificuldades encontradas durante as medições industriais do pH são devidas a esse fato. Uma junção entupida se reconhece fácilmente a partir da medição da sua resistência elétrica.
- Limpe a junção com um pano e coloque-a numa solição de KCl diluida. Mantenha em banho-maria até 80 ºC durante uma hora.
- Se persistir o entupimento, mantenha em banho-maria até 80 ºC durante uma hora numa solução de HCl diluida.
- Quando o entupimento é devido a AgCl ou outros precipitados de prata, coloque a junção durante algumas horas numa Solução de Limpeza de Junção HC0016. Após qualquer tratamento que vise recuperar um eletrodo, descarte a solução de preenchimento e ponha, no eletrodo uma solução eletrolítica nova. Em seguida deixe por pelo menos 30 minutos na Solução de Descanso de Eletrodo HC0018
CONSERVAÇÃO DOS ELETRODOS DE REFERÊNCIA
O eletrodo de referência deve ser conservado com a sua junção imersa numa solução preparada especificamente para cada eletrodo, consulte-nos.
ELETRODOS DE JUNÇÃO DUPLA
Soluções contendo sulfetos, ions chumbo, prata e mercúrio, gases amônia e cloro, proteínas e substâncias coloidais como os látex e os taninos, são conhecidas por provocar o entupimento prematuro da junção ou intrferir com a operação do eletrodo de referência simples. Em casos destes, é imperativo proteger o sistema de referência e o eletrólito de preenchimento como num eletrodo de junção dupla.
O compartimento interno desse tipo de eletrodo consiste num elemento selado contendo um sistema de referência completo e a junção cerâmica usual. Essa junção comunica-se com um compartimento externo que contém uma solução compatível com o processo. De maneira geral, o compartimento externo deve ser preenchido com uma solução de força iônica similar aquela do processo. Consulte-nos para saber qual a solução adequada para uso no compartimento externo para cada aplicação.
ELETRODOS REDOX
Para medir os potenciais ORP / REDOX recorre-se a eletrodos metálicos, geralmente de platina e ouro.
Ao contrário dos eletrodos para pH e íons-sensíveis, que, por natureza, são altamente específicos, os eletrodos redox são inertes.
CAMPO DE APLICABILIDADE DO ELETRODO ORP / REDOX
Esse tipo de eletrodo refere-se as reações químicas em solução que operam apenas por transferência de elétrons. Tais reações ocorrem com elementos e compostos apresentando dois ou mais estados de oxidação.
Exemplos tradicionais são os sistemas Fe²+/Fe³+, Cr6+/Cr³+, (SO4)²-/(SO3)²-, (ClO)-/Cl, (CNO)-/CN-.
PRINCÍPIO DE FUNCIONAMENTO DO ELETRODO REDOX
Por intercâmbio de elétrons com o sistema ORP / REDOX a medir, o eletrodo recebe uma tensão igual ao potencial eletroquímico desse sistema. É importante notar que esse intercâmbio de elétrons entre o sistema e o eletrodo só ocorre livremente nos sistemas ORP / REDOX reversíveis. Por essa razão, uma reação química em solução na qual resulta a evolução de um gás ou a formação de um precipitado, ou que apresenta qualquer outra forma de irreversibilidade é, por definição inadequada para uma medição ORP / REDOX.
O valor potencial ORP / REDOX transmitido pelo eletrodo informa apenas sobre o estado de equilíbrio do sistema, isto é, sobre a proporção relativa da forma oxidada e da forma reduzida. Portanto, o conhecimento do potencial ORP / REDOX não permite por si só deduzir uma concentração.
O que determina o valor potencial é a razão entre as atividades ou concentrações da forma oxidada e da forma reduzida. Quantativamente, a equação de NERNST descreve essa dependência:
E = Eo + 2,3RT/nF log (Aox)/(Ared)
Onde:
E = potencial medido entre o eletrodo redox e o eletrodo de referência.
Eo = potencial padrão do sistema em estudo, Valores tabelados disponíveis nos livros especializados.
R = constante geral dos gases.
T = temperatura absoluta.
F = constante de Faraday.
n = número de elétrons transferidos entre a forma oxidada e a forma reduzida.
Aox = atividade da forma oxidada.
Ared = atividade da forma reduzida.
NOTA: Para soluções diluidas a atividade iônica é equivalente a concentração.
INFLUÊNCIA DO pH E DA TEMPERATURA
Nos sistemas de óxido-redução em que os íons H+ participem também da reação, o potencial redox depende do pH. Para obter uma descrição completa de tais sistemas é preciso indicar, além do eletrodo de referência utilizado, o valor do pH.
A temperatura tem dois efeitos sobre os potenciais redox. Em primeiro lugar ela entra como fator sobre o termo logarítimo da equaçã de Nernst.
Isso significa que para uma determinada razão de atividade iônica, o eletrodo resenvolverá um potencial diferente a uma temperatura diferente. Em segundo lugar, a temperatura influencia a atividade iônica de cada ion na solução.
APLICAÇÃO DOS ELETRODOS REDOX EM CONTROLE DE PROCESSOS
A aplicação das medições redox a uma situação prática implica o conhecimento prévio de alguns fatores: presença de contaminantes capazes de competir com a reação redox principal, valores aproximativos dos coeficientes de atividade dos ions entrando na equação final da voltagem, velocidade aproximativa da reação a ser controlada, necessidade ou não de controle do pH.
Obstáculos que não são insuperáveis considerando as numerosas aplicações bem sucedidas.
Um tipo de controle comumente usado consiste em manter o potencial redox acima do valor necessário para completar a reação de um dos reagentes.
TERMOCOMPENSADORES
O termocompensador fornece continuamente e automaticamente a correção de temperatura durante as medições de pH. Na construção entre um elemento termossensível cuja resistência varia de acordo com as flutuações de temperatura da solução.
pH, Condutividade, ORP/Redox, Celas Eletroquímicas, Automação, Referências CuSO4, Ag/AgCl, Hg/Hg2Cl2, Hg/HgO, Hg/Hg2SO4.








